MASA MOLAR
La masa molecular relativa es un número que indica cuántas veces mayor es la masa de una molécula de una sustancia con respecto a la unidad de masa atómica. Su unidad es el Dalton o unidad de masa atómica, que se abrevia u (antes uma).
La masa molecular se determina sumando las masas atómicas relativas de los elementos cuyos átomos constituyen una molécula de dicha sustancia. A pesar de que se sigue diciendo popularmente peso molecular, el término correcto es masa molecular. La masa molar de una sustancia coincide numéricamente con la masa molecular, aunque son cosas distintas.
La fórmula para calcular es: % elemento X= [(núm. átomos de X)·Ar(X)/Mr]·100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula. Así, en el caso de la molécula de agua, H2O, su masa molecular sería:
(masa atómica del H: 1,00797, masa atómica del O: 15,9994)
Se multiplica por 2, ya que la molécula de agua contiene 2 átomos de hidrógeno (H).
MOL
Dada cualquier sustancia (elemento químico, compuesto o material) y considerando a la vez un cierto tipo de entidades elementales que la componen, se define como un mol a la cantidad de esa sustancia que contiene tantas entidades elementales del tipo considerado, como átomos hay en 12 gramos de carbono-12. Esta definición no aclara a qué se refiere con cantidad de sustancia y su interpretación es motivo de debates, aunque normalmente se da por hecho que se refiere al número de entidades.
El número de unidades elementales –átomos, moléculas, iones, electrones, radicales, u otras partículas o grupos específicos de éstas– existentes en un mol de sustancia es, por definición, una constante que no depende del material ni del tipo de partícula considerado. Esta cantidad es llamada número de Avogadro (NA)2 y equivale a:

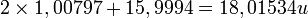
No hay comentarios:
Publicar un comentario